Основы учения о химическом равновесии
Согласно второму закону термодинамики необратимый процесс производит энтропию ( Sdi ), и величина Sdi всегда положительна ( Sd > 0 i ), если процесс протекает в неравновесной системе. И только если система равновесна и самопроизвольный процесс идет обратимым путем, Sd = 0 i .
Так для реакции, не производящей полезной работы и протекающей в системе, где давление и температура сохраняются постоянными, справедливо соотношение (1.22):
Так как величина ∆GT определяется только свойствами реагентов в выбранном стандартном состоянии и не зависит от состава системы ( ∆GT = const), то правая часть соотношения есть величина постоянная, следовательно, выражение под логарифмом также является постоянной величиной.
Стандартную константу равновесия можно выразить и через мольные доли реагентов в равновесной смеси.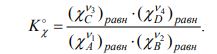
Задача определения равновесного состава химической системы сводится к решению алгебраического уравнения, где в качестве неизвестной выбирается величина, так или иначе количественно определяющая глубину химического изменения системы при переходе от начального состояния к равновесному.
При термодинамическом описании многокомпонентных систем, где могут протекать нескольких химических реакций, пользуются принципом детального равновесия. Этот принцип гласит, что в равновесной системе все возможные процессы равновесны.
Во-первых, система может быть метастабильной. Это значит, что она находится в состоянии с локальным минимумом свободной энергии, при этом существует, по крайней мере, еще одно состояние с еще более низкой свободной энергией (назовем его состоянием истинного равновесия).
Но система не может достичь истинного равновесия, поскольку придется пройти через состояния с более высокой свободной энергии, чем то, в котором она находится (рис. 1.2).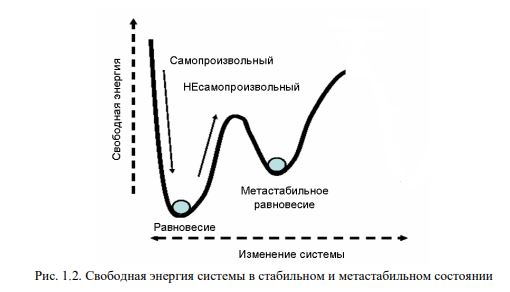
Примером такой ситуации является потенциальная энергия мяча, лежащего в колее на вершине склона: мяч должен перекатиться через край колеи, то есть перейти в состояние с более высокой энергией, прежде, чем он сможет покатиться с горы в ущелье, достигая состояния с самой низкой потенциальной энергией.
Чтобы выйти из метастабильного состояния в переохлажденной жидкости должны появиться центры кристаллизации. Во-вторых, изменение системы может быть слишком медленным, чтобы его можно было заметить и наблюдать.
Рассмотрим, к примеру, камень, лежащий на наклонной поверхности. Силы гравитации будут пытаться сдвинуть его вниз по склону, но сопротивление – силы трения между камнем и поверхностью – может быть слишком большим, в таком случае мы не будем наблюдать заметного движения камня.
- Силы внутреннего трения жидкости. Уравнение Ньютона
- Идеальные модели деформирующихся систем
- Основные понятия реологии
- Учение о процессах деформации систем
- Теория абсолютных скоростей реакции
- Температурная зависимость скорости реакции
- Теория Дебая–Хюккеля
- Растворы электролитов при диссоциации
- Самоассоциация и электрическое экранирование










