Природа потенциала покоя
Еще в 1896 г. В. Ю. Чаговец высказал гипотезу об ионном механизме электрических потенциалов в живых клетках и сделал попытку применить для их объяснения теорию электролитической диссоциации Аррениуса. В 1902 г. Ю. Бернштейном была развита мембранно-ионная теория, которую модифицировали и экспериментально обосновали Ходжкин, Хаксли и Катц (1949—1952). В настоящее время последняя теория пользуется всеобщим признанием. Согласно указанной теории, наличие электрических потенциалов в живых клетках обусловлено неравенством концентрации ионов Na⁺, K⁺, Са ²⁺ и С1~ внутри и вне клетки и различной проницаемостью для них поверхностной мембраны.
Из данных табл. 1 видно, что содержимое нервного волокна богато К ⁺ и органическими анионами (практически не проникающими через мембрану) и бедно Na ⁺ и С1~.
Концентрация К⁺ в цитоплазме нервных и мышечных клеток в 40—50 раз выше, чем в наружном растворе, и если бы мембрана в покое была проницаема только для этих ионов, то потенциал покоя соответствовал бы равновесному калиевому потенциалу (Ек), рассчитанному по формуле Нернста:
![]()
где R — газовая постоянная, F — число Фарадея, Т — абсолютная температура,
Ко — концентрация свободных ионов калия в наружном растворе, Ki — их концентрация в цитоплазме
![]()
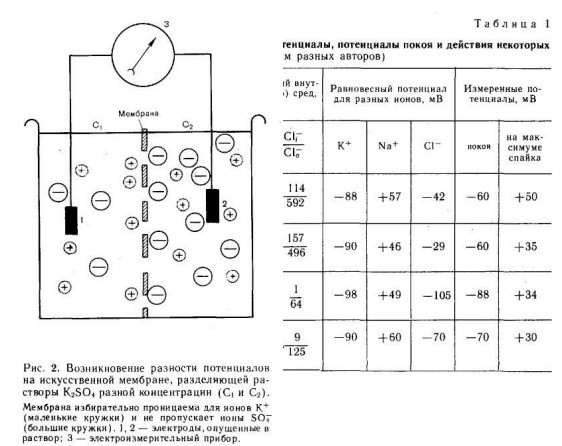
Чтобы понять, каким образом возникает этот потенциал, рассмотрим следующий модельный опыт (рис. 2) .
Представим сосуд, разделенный искусственной полупроницаемой мембраной. Стенки пор этой мембраны заряжены электроотрицательно, поэтому они пропускают только катионы и непроницаемы для анионов. В обе половины сосуда налит солевой раствор, содержащий ионы К⁺, однако их концентрация в правой части сосуда выше, чем в левой. Вследствие этого концентрационного градиента ионы К ⁺ начинают диффундировать из правой половины сосуда в левую, принося туда свой положительный заряд. Это приводит к тому, что непроникающие анионы начинают скапливаться у мембраны в правой половине сосуда. Своим отрицательным зарядом они электростатически будут удерживать К ⁺ у поверхности мембраны в левой половине сосуда. В результате мембрана поляризуется, и между двумя ее поверхностями создается разность потенциалов, соответствующая равновесному калиевому потенциалу (£к).
Предположение о том, что в состоянии покоя мембрана нервных и мышечных волокон избирательно проницаема для К ⁺ и что именно их диффузия создает потенциал покоя, было высказано Бернштейном еще в 1902 г. и подтверждено Ходжкиным с сотр. в 1962 г. в опытах на изолированных гигантских аксонах кальмара. Из волокна диаметром около 1 мм осторожно выдавливали цитоплазму (аксоплазму) и спавшуюся оболочку заполняли искусственным солевым раствором. Когда концентрация К ⁺ в растворе была близка к внутриклеточной, между внутренней и наружной сторонами мембраны устанавливалась разность потенциалов, близкая к значению нормального потенциала покоя (—50-=— 80 мВ), и волокно проводило импульсы. При уменьшении внутриклеточной и повышении наружной концентрации К. ⁺ потенциал мембраны уменьшался или даже изменялся его знак (потенциал становился положительным, если в наружном растворе концентрация К⁺ была выше, чем во внутреннем).
Такие опыты показали, что концентрированный градиент К ⁺ действительно является основным фактором, определяющим величину потенциала покоя нервного волокна. Однако покоящаяся мембрана проницаема не только для К ⁺, но (правда, в значительно меньшей степени) и для Na⁺. Диффузия этих положительно заряженных ионов внутрь клетки уменьшает абсолютную величину внутреннего отрицательного потенциала клетки, создаваемого диффузией К⁺. Поэтому потенциал покоя волокон (—50 – 70 мВ) менее отрицателен, чем рассчитанный по формуле Нернста калиевый равновесный потенциал.
Ионы С1~ в нервных волокнах не играют существенной роли в генезе потенциала покоя, поскольку проницаемость для них покоящейся мембраны относительно мала. В отличие от этого в скелетных мышечных волокнах проницаемость покоящейся мембраны для ионов хлора сравнима с калиевой, и потому диффузия С1~ внутрь клетки увеличивает значение потенциала покоя. Рассчитанный хлорный равновесный потенциал (Еcl) при соотношении
![]()
Таким образом, величина потенциала покоя клетки определяется двумя основными факторами:
- соотношением концентраций проникающих через покоящуюся поверхностную мембрану катионов и анионов;
- соотношением проницаемостей мембраны для этих ионов.
Для количественного описания этой закономерности используют обычно уравнение Гольдмана — Ходжкина — Катца:
![]()
где Em — потенциал покоя, Р к, PNₐ, Pcl — проницаемости мембраны для ионов К ⁺, Na⁺ и С1~ соответственно; K₀⁺ Na₀⁺; Cl₀⁻ — наружные концентрации ионов К ⁺, Na⁺ и Сl ⁻ a Ki⁺ Nai⁺ и Cl i⁻ — их внутренние концентрации.
Было рассчитано, что в изолированном гигантском аксоне кальмара при E m = —50 мВ имеется следующее соотношение между ионными проницаемостями покоящейся мембраны:
![]()
Уравнение дает объяснение многим наблюдаемым в эксперименте и в естественных условиях изменениям потенциала покоя клетки, например ее стойкой деполяризации при действии некоторых токсинов, вызывающих повышение натриевой проницаемости мембраны. К таким токсинам относятся растительные яды: вератридин, аконитин и один из наиболее сильных нейротоксинов — батрахотоксин, продуцируемый кожными железами колумбийских лягушек.
Деполяризация мембраны, как это следует из уравнения, может возникать и при неизменной PNA, если повысить наружную концентрацию ионов К ⁺ (т. е. увеличить отношение Ko/Ki). Такое изменение потенциала покоя является отнюдь не только лабораторным феноменом.
Дело в том, что концентрация К ⁺ в межклеточной жидкости заметно повышается во время активации нервных и мышечных клеток, сопровождающейся повышением Р к. Особенно значительно возрастает концентрация К ⁺ в межклеточной жидкости при нарушениях кровоснабжения (ишемия) тканей, например ишемии миокарда. Возникающая при этом деполяризация мембраны приводит к прекращению генерации потенциалов действия, т. е. нарушению нормальной электрической активности клеток.










